Mitochondria i koenzym Q10
Mitochondria to organelle komórkowe, centrum energetyczne każdej komórki organizmu eukariontów. Odgrywają rolę w metabolizmie lipidów, nukleotydów, apoptozie, sygnalizacji komórkowej, mają wpływ na gospodarkę wapniową oraz biorą udział w procesach buforowania wapnia w organizmie [1]. Ich najważniejszym zadaniem jest produkcja energii poprzez fosforylację oksydacyjną. Cały system fosforylacji oksydacyjnej jest złożony z pięciu kompleksów białkowych. Kompleksy I i II przekazują elektrony ze zredukowanych nukleotydów (dinukleotydu nikotynoamidoadeninowego – NADH i dinukleotydu flawinoadeninowego – FADH2) na zlokalizowany w błonie niebiałkowy nośnik elektronów, mitochondrialny koenzym Q (mQ), który przekazuje elektrony na kompleks III. Ostatecznie elektrony przenoszone są przez cytochrom c na kompleks IV. W efekcie tych działań elektrony są przenoszone z macierzy mitochondrialnej do przestrzeni międzybłonowej przez kompleksy I, III i IV. Tworzy się protonowy gradient elektrochemiczny, który powoduje zwrotny przepływ protonów przez syntazę ATP i w ten sposób produkcję ATP. Jeżeli łańcuch oddechowy nie działa, zmniejsza się produkcja energii i wzrasta produkcja toksycznych mitochondrialnych reaktywnych form tlenu (mRFT). Uszkodzone mitochondria dodatkowo uwalniają czynniki apoptotyczne, które są sygnałami wywołującymi śmierć komórki [2].
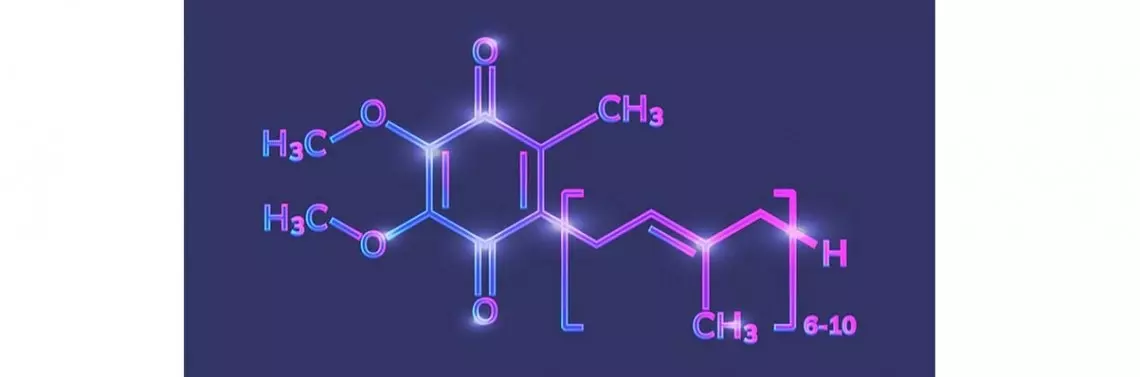
Formy koenzymu Q10
Koenzym Q10 jest częścią mitochondrialnego łańcucha oddechowego. Występuje w trzech różnych stanach oksydoredukcyjnych: całkowicie utlenionym (chinon, Q), całkowicie zredukowanym (chinol, QH2) oraz jako rodnik semichinonowy (semichinon, QH•). Koenzym Q10 został po raz pierwszy wyizolowany z mitochondriów serca wołu przez Crane i wsp. w 1957 r. [3] Koenzym Q10 odbiera elektrony od szeregu oksydoreduktaz, które redukują go do QH2 [4].
POLECAMY
Koenzym Q10 w roli przeciwutleniacza
Organizmy eukariotyczne są zdolne do biosyntezy koenzymu Q10. Początek procesu zachodzi w retikulum endoplazmatycznym, a koniec w aparacie Golgiego, skąd koenzym Q przenoszony jest do innych miejsc w komórce [5]. Dysfunkcj...